
Full resolution (TIFF) - On this page / på denna sida - Spektralanalyse

<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
modsat Side. Betydningen af Opløsningen i
Serier omtales ndf. Alle Na-linier og alle de
flg. Alkalimetallers Linier er dobbelte; det ses
paa nogle af Linierne i Fig. 5 forneden, mens
de to Linier i hvert Par ligger for tæt sammen
til at ses adskilte i Fig. 4.
De fleste andre Spektre er endnu mere
komplicerede, meget linierigere, og Linierne
optræder i Grupper paa 3 (Tripletter), 4, 5. ., idet
dog saadanne Grupper ofte er saa stærkt
adskilte, at talrige andre Linier falder ind
derimellem. Et endnu relativt simpelt
Tripletspektrum, Zinkspektret, er vist i Tavlens Fig. 6,
hvor de 3 sammenhørende Linier i hver Triplet
er mærket forneden. Nogle Tripletter med
større Adskillelse tilhører Cadmium, der har
været til Stede som Urenhed. Betydningen af
Bogstaverne s og d omtales ndf. Et særdeles
linierigt Spektrum er Jernspektret, som det
fremgaar af Tavlens Fig. 1, men man kender
endnu meget mere komplicerede Spektre,
saaledes de fleste sjældne Jordarters.
Til en nøjagtig Beskrivelse af et Stofs
Spektrum hører foruden Angivelse af hver Linies
Bølgebredde og relative Styrke ogsaa en
nærmere Beskrivelse af Linierne, idet de viser
karakteristiske kvalitative Forskelligheder.
Nogle Linier viser let Selvabsorption (se ndf.);
nogle er udpræget skarpe, andre mere ell.
mindre uskarpe (diffuse), og denne Uskarphed kan
være symmetrisk ell. kun til den ene Side og
da mod kortere Bølgebredder for nogle, mod
lange for andre. Til Karakterisering af den
enkelte Linie hører endvidere Kendskab til
Zeeman-Effekten ell. den Maade, hvorpaa Linien
paavirkes af, at Lyskilden befinder sig i et
magnetisk Felt, til Stark-Effekten ell.
Paavisningen af et elektrisk Felt, til Liniens Ændring
ved en Trykændring i Lyskilden m. m. (forøget
Tryk gør gerne Linierne uskarpere,
begunstiger Selvabsorption og forskyder Liniens
Midte lidt mod længere Bølgebredde), men
disse sidste Forhold kræver særlige, ofte
omfattende Undersøgelser. Hvad Kendskabet til
selve Spektrene angaar, er Resultatet af de
sidste 40 Aars Undersøgelser et overordentlig
omfattende Materiale, paa Grundlag af hvilket
man tør hævde, at alle Stoffers Spektre er godt
kendte i det synlige og nærmeste ultraviolette
Omraade, om end Materialets Værdi er ret
uensartet, og største Delen af Maalingerne
endnu er i Rowland’s Skala. Derimod er
Kendskabet til Spektrenes ultrarøde og yderste
ultraviolette Del endnu ret mangelfuldt; for den
sidste Dels Vedk. bringer dog hvert Aar betydelige
Fremskridt.
c). Liniespektrenes Teori. Efter
Balmer’s Opdagelse blev der især af Rydberg i
Lund og Kayser og Runge fra 1890 gjort et
betydeligt Arbejde paa at finde lgn.
Lovmæssigheder i Ordningen af Linierne i andre Stoffers
Spektre. For fl. Stoffer, især Alkalimetallerne,
men ogsaa enkelte andre, lykkedes det hurtigt
at indordne et stort Antal af Linierne i lgn.
Serier med tættere og tættere Ophobning af
Linierne hen imod en Grænse, men for hvert Stof
var der fl. saadanne Serier, og Liniernes
Svingningstal kunde ikke udtrykkes ved en saa
simpel Formel som for Brint. Et meget stort
Arbejde blev derefter gjort for at finde det
nøjagtige mat. Udtryk for
Lovmæssigheden i disse Spektre, men uden egl.
Held. Dog fandt Rydberg fl. vigtige
Lovmæssigheder, og Ritz opdagede
1908 det saakaldte
Kombinationsprincip (se ndf.). Imidlertid
ændredes det teoretiske Grundlag for S.
fuldstændigt ved N. Bohr’s
epokegørende Arbejder 1913 og følgende Aar,
hvorved S. fra at være en væsentlig
empirisk Videnskab blev et af de vigtigste Afsnit
af Fysikken, idet den paa den ene Side fik
det faste teoretiske Grundlag, som er
nødvendigt for metodisk og udbytterigt Arbejde, og
paa den anden Side viste sig at kunne give de
mest direkte Oplysninger om Atomers og
Molekylers Bygning. Grundlaget for Bohr’s
Anskuelser om Atomets Bygning og Spektrenes
Udsendelse, der er omtalt udførligt under
Kvanteteori (S. 7—13, citeret i det flg. som Kv.), er
de to flg. Postulater:
I. Et Atom kan kun eksistere i længere Tid
i en vis Rk. Tilstande svarende til en
diskontinuert Rk. af Værdier for dets Energi, saa at
enhver Forandring af dets Energi, ogsaa
Emission og Absorption af Straaling, kun kan finde
Sted ved en fuldstændig Overgang mellem to
saadanne Tilstande. Disse Tilstande kaldes
Atomets stationære Tilstande.
II. Den Straaling, der absorberes ell.
emitteres under en saadan Overgang mellem to
stationære Tilstande, har eet bestemt
Svingningstal v’ givet ved E′ — E″ =; hv’. hvor h er
Planck’s Konstant, og hvor E′ og E″ er
Energiværdierne i de to betragtede Tilstande.
I en ikke lysende Damp findes alle Atomer i
den saakaldte Normaltilstand, hvori de har
det mindste Energiindhold. Ved de Processer
(elektriske Udladninger, Opvarmning o. s. v.),
hvorved Dampen bringes til at lyse, tilføres den
fornødne Energi, til at en større ell. mindre Del
af Atomerne kan bringes over i andre af de
stationære Tilstande med større Energi. Derfra
gaar Atomet da igen gennem fl. ell. færre
»Spring« over i Normaltilstanden, idet hvert
Spring er ledsaget af Udsendelse af Energi i
Form af en af Stoffets karakteristiske
Spektrallinier. Alle de til et Stofs Spektrum hørende
Linier stammer altsaa hver fra sin af de mulige
Overgange, og den større ell. mindre Intensitet,
hvormed de forsk. Linier optræder, hænger
sammen med den større ell. mindre
Sandsynlighed for netop den tilsvarende Overgang. Bohr’s
Frekvensbetingelse hv’ = E′ — E″ kan skrives
v’ = E′/h — E″/h ell. v = E′/hc — E″/hc = T2—T1,
idet T2 = — E″/hc og T1 — — E′/hc. Herved er
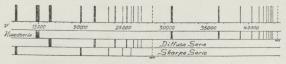 |
| Fig. 11. Lithiumspektret og dets Serier. |
<< prev. page << föreg. sida << >> nästa sida >> next page >>