
Full resolution (TIFF) - On this page / på denna sida - Røntgenstraaler

<< prev. page << föreg. sida << >> nästa sida >> next page >>
Below is the raw OCR text
from the above scanned image.
Do you see an error? Proofread the page now!
Här nedan syns maskintolkade texten från faksimilbilden ovan.
Ser du något fel? Korrekturläs sidan nu!
This page has been proofread at least once.
(diff)
(history)
Denna sida har korrekturlästs minst en gång.
(skillnad)
(historik)
først fjernes en af de to K-Elektroner, hvilket
hesørges af den Elektron, der falder ind mod
Antikatoden. Dette er i Fig. antydet ved Pilen
mærket K-Abs (Betegnelsen Abs henviser til, at
dette ogsaa kan ske ved R.-absorption, der
omtales ndf.). Derefter udfyldes den tomme Plads
med en af de andre Elektroner. Det
sandsynligste er, at det bliver en af de nærmeste,
d. v. s. en L-Elektron, der udfylder Pladsen;
derved udsendes Kα, der er den stærkeste
K-Linie, men Udfyldningen kan ogsaa ske med en
M-Elektron, hvorved Kβ udsendes o. s. v. Da
Udfyldningen med en L-Elektron kan ske paa
to Maader, nemlig fra hver af de 2
L-Undergrupper, faas Kα dobbelt. Hyppigst bruges
i St f. Fig. 12 en noget anden Fremstilling. Vi
kalder Atomets Energiindhold, naar det er
berøvet en K-Elektron, EK og Energien, naar der
er fjernet en L-Elektron, EL. Naar derfor en
K-Elektron er fjernet, og dens Plads udfyldes
af en L-Elektron, ændres Atomets Energi fra
EK til EL, d. v. s., der kan udstraales
Energimængden EK~EL, og beregnes deraf den
udstraalede Frekvens efter Kvantebetingelsen, faas
Frekvensen af Kα, altsaa hKα = EK — EL . I
St f. at afbilde Atomets Tilstande symbolsk,
afbildes nu disses Energiværdier ell. rettere
EK/h, EL/h, de saakaldte Energiniveauer. Dette
er gjort i Fig. 13, dog ikke i rigtigt indbyrdes
Størrelsesforhold, og for Simpelheds Skyld er
L-, M- o. s. v. Niveauerne tegnet enkelt. Før
Atomet kan begynde at udstraale K-Straaling,
skal den ene K-Elektron fjernes, hvortil
kræves, at der mod Stoffet som Antikatode i et
R.-rør falder en Elektron ind, der har Energi nok
til at gøre det, d. v. s. bringe Atomet fra det
normale Niveau op til K-Niveauet, antydet ved
Pilen til venstre. Derefter kan Atomets indre
Del igen bliver normal ved en af de med
nedadrettede Pile antydede Overgange, hvorved den
paagældende Linie udsendes. Har man altsaa en
Del Atomer, der er berøvet en K-Elektron, vil
de fleste faa den erstattet af en L-Elektron,
færre af en M-Elektron, endnu færre af en
N-Elektron o. s. v., saa at Liniernes Intensitet i
K-Spektret falder i denne Rækkefølge. Derved
forstaar man, at hele K-Spektret altid kommer
samtidig, thi naar først K-Elektronen er
fjernet, vil altid nogle Atomer udfyldes paa den ene
Maade, andre paa den anden, idet
Sandsynlighedslovene bestemmer, hvor mange af hver
Slags Overgange der sker. Tillige forstaas, at
Betingelsen for at faa K-Spektret frem er, at
den indfaldende Elektron skal have Energi nok
til at fremkalde den haardeste K-Linie og endda
en Smule mere. Thi den skal kunne fjerne
K-Elektronen helt, og den dertil krævede Energi
er maalt ved den venstre Pils Længde,
hvorimod den haardeste K-Linies Energi er maalt
ved den lidt kortere Pil Kβ2. Men Forskellen
er kun lille, da de yderste Niveauers Forskel
er lille i Forhold til Afstanden til K-Niveauet,
meget mindre end fremstillet paa Fig. Vender
vi os nu til L-Spektret, fremkaldes det paa
tilsvarende Maade ved Fjernelse af en L-Elektron
og Udfyldelse af dens Plads med en af de
andre Elektroner udenfor, en M-, N- o. s. v.
Elektron. Det forstaas, at L-Straalingen er langt
blødere, da der er Tale om langt mindre
Energiforskelle til Udstraaling, altsaa mindre Kvanter,
d. v. s. mindre Frekvens og større Bølgebredde.
Endvidere, at de simplest byggede Stoffer med
lavt Nr. og faa Elektroner giver simplere
L-Spektre end de højere, fordi der ikke er saa
mange forsk. Slags Elektroner til at udfylde
den tomme Plads. For at forklare alle Detailler
i hele Spektret maatte man have en nøjagtigere
Tegning af hele Niveauskemaet. At der er 3
L-Linie-Undergrupper og altsaa 3 L-Niveauer,
til Trods for at der kun er 2 Undergrupper i
L-Elektronerne, ligger i, at en af disse
Undergrupper kan ordne sig paa 2 lidt forsk.
Maader, naar en af dens Elektroner er fjernet,
hvilket repræsenterer 2 L-Niveauer. Dog
fremkommer ikke alle de Linier, som skulde være mulige
efter det fuldstændige Niveauskema, idet der er
visse Overgange, som faktisk ikke indtræffer.
Man kan rent empirisk inddele Niveauerne i 2
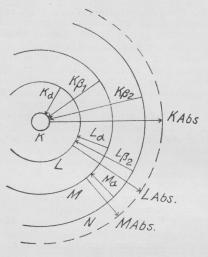 |
| Fig. 12. Røntgenspektrenes Udsendelse (skematisk). |
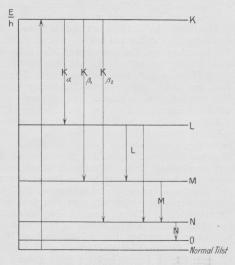 |
| Fig. 13. »Røntgenniveauer«. |
<< prev. page << föreg. sida << >> nästa sida >> next page >>